LEO Pharma, laboratorio especializado en dermatología médica, ha anunciado este lunes que la Comisión Europea (CE) ha concedido la autorización de comercialización de la crema Anzupgo® (delgocitinib) para el tratamiento de pacientes adultos con eccema crónico de manos (ECM) de moderado a grave para quienes los corticosteroides tópicos son inadecuados o inapropiados.
La aprobación de la CE es válida en todos los Estados miembros de la Unión Europea, Islandia, Noruega y Liechtenstein. Esta noticia es la última de una serie de hitos regulatorios a nivel mundial.
"Estamos dedicados a mejorar el estándar de atención para quienes viven con afecciones de la piel, y este hito tan esperado demuestra nuestro propósito en la práctica", ha comentado Christophe Bourdon, director ejecutivo de LEO Pharma. "Esta aprobación proporciona una nueva opción de tratamiento para los pacientes y esperamos coordinar los próximos pasos necesarios para proporcionarlo a aquellos pacientes que lo necesiten".
Delgocitinib es un inhibidor tópico pan-JAK para el tratamiento del ECM de moderado a grave. Inhibe la activación de la señalización JAK-STAT, que desempeña un papel clave en la patogénesis del ECM. Actualmente, no existen otros tratamientos tópicos aprobados específicamente para adultos con ECM de moderado a grave para quienes los corticosteroides tópicos son inadecuados o inapropiados.
"Esta aprobación es la culminación de años de concentración y esfuerzo, impulsados cada día por el objetivo de apoyar a esta población de pacientes", ha añadido Marcin Kozarzewski, Director Médico de LEO Pharma Iberia. "La nueva opción de tratamiento tiene como objetivo apoyar el tratamiento de esta enfermedad debilitante, dadas las limitadas opciones de tratamiento para el ECM aprobadas actualmente en toda Europa".
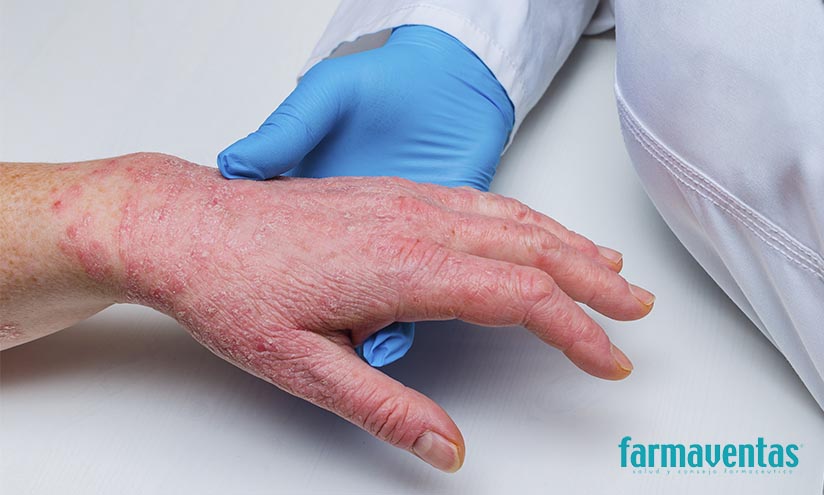
El ECM es una enfermedad cutánea inflamatoria, heterogénea y fluctuante con síntomas clave de picor y dolor. Su fisiopatología se caracteriza por disfunción de la barrera cutánea, inflamación de la piel y alteraciones del microbioma cutáneo. La afección puede tener una gran carga psicológica, social y laboral.
La aprobación de delgocitinib se basa en los resultados de los ensayos clínicos de fase 3 DELTA 1 y DELTA 2 que evaluaron la seguridad y eficacia del tratamiento en comparación con el vehículo en crema. Ambos ensayos cumplieron con sus criterios de valoración primarios y secundarios. A los pacientes que completaron los ensayos DELTA 1 o DELTA 2 de 16 semanas se les ofreció inmediatamente participar en el ensayo de extensión abierto DELTA 3 de 36 semanas.
Acerca de la crema Anzupgo® (delgocitinib)
La crema Anzupgo® (delgocitinib) es un inhibidor tópico pan-Janus quinasa (JAK) para el tratamiento del ECM de moderado a grave. Inhibe la activación de la señalización JAK-STAT, que desempeña un papel clave en la patogénesis del ECM. La fisiopatología se caracteriza por disfunción de la barrera cutánea, inflamación de la piel y alteraciones del microbioma cutáneo. Anzupgo está actualmente aprobado en la Unión Europea para el tratamiento del eczema crónico de manos (ECM) de moderado a grave en adultos para quienes los corticosteroides tópicos son inadecuados o inapropiados. En 2014, LEO Pharma A/S y Japan Tobacco Inc. (JT) firmaron un acuerdo de licencia en el que LEO Pharma obtuvo derechos exclusivos para desarrollar y comercializar la crema de delgocitinib para uso tópico en indicaciones dermatológicas en todo el mundo, excepto Japón, donde JT conserva los derechos.
Acerca de las pruebas DELTA 1, 2 y 3
El objetivo principal de los ensayos clínicos de fase 3 multicéntricos, aleatorizados, doble ciego, controlados por vehículo (DELTA 1 y DELTA 2) fue evaluar la eficacia de las aplicaciones dos veces al día de Anzupgo® en comparación con el vehículo en crema en el tratamiento de adultos. con ECM de moderado a grave.
El criterio de valoración principal de los ensayos fue la Evaluación global del investigador para el éxito del tratamiento del eccema crónico de manos (IGA-CHE TS) en la semana 16. El éxito del tratamiento se definió como una puntuación IGA-CHE de 0 (claro) o 1 (casi claro) con al menos al menos una mejora de dos pasos desde el inicio. Las puntuaciones adicionales de IGA-CHE incluyeron 2 (leve), 3 (moderado) y 4 (grave).
Los criterios de valoración secundarios clave en la semana 16 incluyeron la reducción de las puntuaciones de picor y dolor de ≥4 puntos medidos por el diario de síntomas de eczema de manos (HESD) desde el inicio hasta la semana 16, así como una mejora de al menos el 75 % desde el inicio y al menos el 90 % desde el inicio en el índice de gravedad del eccema de manos (HECSI) en la semana 16. El número de eventos adversos surgidos del tratamiento desde el inicio hasta la semana 16 definió el criterio de valoración clave de seguridad de los ensayos.
A los pacientes que completaron 16 semanas de tratamiento con Anzupgo o vehículo en crema dos veces al día en los ensayos DELTA 1 o DELTA 2 se les ofreció pasar al ensayo DELTA 3 open-label y extensión multisitio. El propósito de este ensayo de extensión fue evaluar la seguridad a largo plazo de Anzupgo.
Acerca del eccema crónico de manos
El eccema crónico de manos (ECM) se define como eccema de manos (EM) que dura más de tres meses o recae dos o más veces en un año. El EM es el trastorno cutáneo más común de las manos con una tasa de prevalencia de aproximadamente el 4,7%. En un número sustancial de pacientes, el EM puede convertirse en una enfermedad crónica. ECM es un trastorno fluctuante caracterizado por picor y dolor, y los pacientes pueden experimentar signos como eritema, descamación, liquenificación, hiperqueratosis, vesículas, edema y fisuras en manos y muñecas.
Se ha demostrado que el ECM causa cargas psicológicas y funcionales que afectan la calidad de vida del paciente, y aproximadamente el 70 % de las personas que viven con ECM grave admiten problemas para realizar las actividades cotidianas y sufren interrupciones en su vida diaria debido a esta afección.Además, también se ha demostrado que las carreras y el potencial de ingresos se ven afectados por la carga de vivir con ECM.